提起金属相关的化学方程式和反应,大家都知道,有人问有关金属硅的所有化学方程式,另外,还有人想问求碱和金属反应的化学方程式,你知道这是怎么回事?其实,稀,与金属反应的化学方程式和现象,下面就一起来看看有关金属硅的所有化学方程式,希望能够帮助到大家!
金属相关的化学方程式和反应

1、金属相关的化学方程式和反应:有关金属硅的所有化学方程式
1、硅和溶液反应的化学方程式:Si+2NaOH+=+2H2↑
2、硅和溶液反应的离子方程式:Si+2OH—+=—+2H2↑
3、硅和氢氟酸反应的化学方程式:Si+4HF=SiF4↑+2H2↑
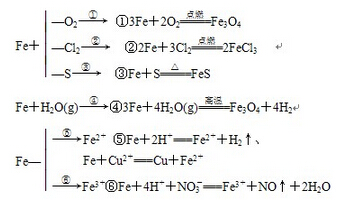
2、金属相关的化学方程式和反应:求碱和金属反应的化学方程式
2Al+2NaOH=2NaAlO2+H2再换KOH

3、金属相关的化学方程式和反应:,稀,与金属反应的化学方程式和现象
1、锌和稀反应:Zn+H₂SO₄=ZnSO₄+H₂↑
2、镁和稀反应:Mg+H₂SO₄=MgSO₄+H₂↑
3、铝和稀反应:2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
4、锌和稀反应:Zn+2HCl=ZnCl₂+H₂↑
5、镁和稀反应:Mg+2HCl=MgCl₂+H₂↑
6、铝和稀反应:2Al+6HCl=2AlCl₃+3H₂↑现象:有气泡产生。
7、铁和稀反应:Fe+2HCl=FeCl₂+H₂↑
8、铁和稀反应:Fe+H₂SO₄=FeSO₄+H₂↑现象:有气泡产生,溶液由无色变成浅绿色。
9、铜与稀、稀均不反应

4、金属相关的化学方程式和反应:初三化学关于酸和金属反应的化学方程式及反应现象
金属活动性上氢之前的金属(和稀酸(,)反应,生成金属离子和。比如:Mg十2HCl=MgCl2十H2

5、金属相关的化学方程式和反应:与金属有关的化学方程式
Mg、Al
1.金属镁在Cl2、O2、N2、CO2、SO2中的燃烧反应.
点燃点燃点燃
Mg+Cl2==+O2==+N2==
点燃点燃
2Mg+CO2==2MgO+C(现象:黑与白)2Mg+SO2==2MgO+S(现象:黄与白)
2.金属铝与O2、Cl2、、S的反应.
常温下:4Al+3O2==(铝表面致密氧薄膜)
点燃点燃△
4Al+3O2==2Al+3Cl2==+3S==
3.Mg和的反应(很缓慢),铝难与热水反应Mg+==Mg(OH)2+H2↑注:Mg(OH)2因生成量很少,不以沉淀形式出现,不写沉淀号。
4.Mg和Al分别与酸的反应.
Mg和Al分别与HCl和稀作用放出H2
Mg+2H2+==Mg2++H2↑2Al+6H+==2Al3++3H2↑
Mg、Al分别与浓、浓.稀HNO3反应,但不放出H2↑。
注:Al、Fe分别与浓、浓HNO3常温下钝化,加热条件下反应放出SO2或NOx
5.Mg不与碱反应,Al与强碱反应放出H2,与弱碱不反应:Al与NH3.不反应
2Al+2NaOH+==2NaAlO2+3H2↑
2Al+2OH-+==2AlO2-+3H2↑2Al+2NaOH+==2NaAlO2+3H2↑+
6.铝热反应:Al与金属氧的反应;现象:放出大量的热.
用途:1)钢轨2)冶炼高熔属Fe、V、Cr、Mn
高温高温
2Al+==+2Fe+==+6V
高温高温
2Al+3FeO==++==+2Cr
高温高温
8Al+==++3MnO2==+3Mn
7.Al、、Al(OH)3分别与HCl和NaOH的反应
2Al+2NaOH+==2NaAlO2+3H2↑2Al+2OH-+==2AlO2-+3H2↑
2Al+6HCl==2AlCl3+3H2↑2Al+6H+==2Al3++3H2↑
+2NaOH==2NaAlO2++2OH-==2AlO2-+
+6HCl==2AlCl3++6H+==2Al3++
Al(OH)3+NaOH==NaAlO2+Al(OH)3+OH-==AlO2-+
Al(OH)3+3HCl==AlCl3+Al(OH)3+3H+==Al3++
8.Mg和Al的工业制法
电解电解
MgCl2(融熔)==Mg+Cl2↑(融熔)==4Al+3O2↑
9.实验室制Al(OH)3的方法
,稀,与金属反应的化学方程式和现象
1)在AlCl3或Al2(SO4)3溶液中加入Al3++3NH3•==Al(OH)3¯+3NH4+
2)在NaAlO2溶液中通入CO2气体2AlO2-+CO2(少量)+==2Al(OH)3¯+-
AlO2-+CO2(过量)+==Al(OH)3¯+HCO3-
3)AlCl3或Al2(SO4)3溶液与NaAlO2溶液混合Al+3AlO2+==4Al(OH)3↓
10.NaAlO2的性质:
1)与:NaAlO2+HCl+==NaCl+Al(0H)3AlO2-+H++==Al(0H)3
2)与碳酸:
2NaAlO2+CO2(少量)+==2Al(OH)3+2AlO2-+CO2(少量)+==2Al(OH)3¯+-
NaAlO2+CO2(过量)+==Al(OH)3+-+CO2(过量)+==Al(OH)3¯+HCO3-
3)与铝离子:3NaAlO2+AlCl3+=3NaCl+4Al(0H)3Al+3AlO2+=4Al(OH)3↓
10.铝三角
试剂:1)NH3•Al3++3NH3•==Al(OH)3¯+3NH4+Al
2)HCl或稀Al(OH)3+3H+==Al3++
3)HCl或稀Al(OH)3+OH-==AlO2-+
4)通CO2气体AlO2-+CO2(过量)+==Al(OH)3¯+HCO3-
5)过量的NaOH溶液Al3++4OH-==AlO2-+
6)过量的HCl或稀AlO2-+4H+==Al3++Al(OH)3AlO2-
11.互滴问题
1)将NaOH溶液逐滴滴入到AlCl3或Al2(SO4)3溶液中,直至过量。
现象:先产生白色絮状沉淀,当NaOH过量时,产生的沉淀消失。
Al+3OH==Al(OH)3↓Al(OH)3+OH==AlO2+
2)将AlCl3或Al2(SO4)3溶液逐滴滴入到NaOH溶液中,直至过量。
现象:先产生少量沉淀,振荡后消失,当AlCl3过量时,产生的沉淀不再消失。
Al+4OH==AlO2+Al+3AlO2+==4Al(OH)3↓
3)将HCl溶液逐滴滴入到NaAlO2溶液中,直至过量。
现象:先产生白色絮状沉淀,当HCl过量时沉淀消失。
AlO2+H+==Al(OH)3↓Al(OH)3+3H==Al+
4)将NaAlO2溶液逐滴滴入到HCl溶液中,直至过量。
现象:先产生沉淀,振荡后消失,当NaAlO2过量时,产生的沉淀不再消失。
AlO2+4H==Al+2Al+3AlO2+==4Al(OH)3↓1.铁与非金属Cl2、、O2、S、Br2、I2的反应:
2Fe+3Cl2==+2O2==Fe+S==FeS
2Fe+3Br2==+I2==FeI2
2.铁与水蒸气的反应:∆
3Fe+(气)==+4H2
3.铁与酸的反应:
Fe与HCl或稀反应放+2H+==Fe2++H2↑
Fe与浓浓HNO3发生钝化反应.
Fe+4HNO3(稀)==Fe(NO3)3+NO↑+(稀HNO3过量)
3Fe+8HNO3(稀)==3Fe(NO3)2+2NO↑+(Fe过量)Fe+6HNO3(浓)==Fe(NO3)3+3NO2↑+(浓HNO3过量)Fe+4HNO3(浓)==Fe(NO3)2+2NO2↑+(Fe过量)
4.铁与盐溶液的反应:
Fe与CuSO4溶液的反应:Fe+Cu2+==Fe2++Cu
Fe与FeCl3溶液的反应:Fe+2Fe3+==3Fe2+
Fe与AgCl溶液的反应:Fe+Ag+==Fe2++Ag
以上就是与有关金属硅的所有化学方程式相关内容,是关于有关金属硅的所有化学方程式的分享。看完金属相关的化学方程式和反应后,希望这对大家有所帮助!